
現代東洋医学 15, 544−550 (1994)より転載
はじめに
麻黄(Ephedrae Herba)は,裸子植物マオウ科マオウ属植物の地上部からなる生薬で,いまや,世界的なドーピング事件で有名になった有効成分の
ephedrineとともに日本薬局方に収載されている[1].意外なことに,漢方に用いられる生薬(漢方用薬)が有効成分とともに局方品であるものは麻黄の他,薄荷,黄連等わずかの例しかない.
基原植物は日本薬局方では Ephedra sinicaまたはその同属植物と規定されており,中国の薬局方に相当する「中華人民共和国薬典」では同属
sinica種の草麻黄,intermedia種の中麻黄,equisetina種の木賊麻黄が収載されている.
前項を担当された米田博士の文にもあるように,植物学的にマオウの分類は未解決な部分が多くこの他にdistachya
種[2]が有名で,インド,パキスタン方面には丈の大きな gerardiana種が知られ,日本にも輸出されている.
分類の混乱にも関わらず,麻黄は傷寒論以来,漢方処方の中で,最も効果のはっきりした,切れ味の良い薬味として揺るぎない地位を築いている.本稿では,明治時代の我国において構造決定されたエフェドリンを中心に,その関連のアルカロイドの構造と立体化学,それらの分離定量の試み,植物中における生合成経路などを述べ,最後にアルカロイド以外の麻黄の化学成分について触れることにする.
エフェドリンの発見
明治20年(1887),それまで10数年のドイツ留学を終えた長井長義博士は東京衛生試験所の山科氏の依頼により,麻黄成分の研究を行い,エフェドリンおよび,関連アルカロイドの構造を決定した.ついで,医科大学の高橋順太郎博士に薬理学的研究を委託され,エフェドリンの瞳孔散大,血圧上昇作用が明らかとなった.この散瞳作用は眼底検査などに応用されたが,漢方における麻黄本来の薬能と結びつく薬理作用は当時の西洋科学吸収の陰で,忘れ去られた漢方医学のためか,全然,解明されなかった.今世紀に入って,高峰譲吉博士が副腎から単離したホルモンの
adrenaline[3] の作用と構造の関連に着目し,漢方を心得ていた中国の若い薬理学者 陳博士,Schmidt博士が1924年にエフェドリンが気管支喘息に効果があることを見いだした.
以後,エフェドリンの臨床応用は短期間のうちに世界中に広まったという著名な実話がある.
麻黄塩基 (Ephedra alkaloids)
マオウには (-)-ephedrine[4]に代表される6種のアルカロイドが見いだされている.それらはいずれも1-phenyl-2-aminopropanolの基本骨格を共通して有するが,1位と2位の炭素の立体化学によって,2つに大別出来る.すなわち,1R
2S の型をエフェドリン型(天然は総て−体),1S 2Sの型をプソイドエフェドリン型(天然は+体)という.その,各々の型について,N−メチル基の数(0,1,2)によって,それぞれ,norephedrine
(3), ephedrine (1), methylephedrine (5),
norpseudoephedrine (4), pseudoephedrine (2), methylpseudoephedrine
(6) と称する.(Fig.1) これら6種の塩基の詳しい薬理は次項に譲るが,例えばコリンエステラーゼ作用の例を見ても微妙に異なる[5]ため,生薬中のこれらの組成を知る事は,生薬の品質評価,品質管理にとって大切なことである.
分離定量の前に,これらの化合物の化学的性質を簡単に説明する.
麻黄塩基の化学的性質
エフェドリンは強い塩基性を有するため,局方では滴定により定量している.また,第一級アミン(3, 4)と第2級アミン(1,
2)はニンヒドリン試薬に鋭敏に反応して赤紫色を呈する.また,アルカリ性において銅イオンと反応して錯体を形成し,青色を呈する.これは,α−アミノアルコールの部分構造による反応である.また,この部分構造はケトンやアルデヒドのカルボニル化合物と反応して,容易にオキサゾリジン環を形成することが知られている.以前,我々はガスクロで麻黄塩基の定量を企てたことがあるが,その際に,アセトンによるオキサゾリジン環の形成により,1と2の立体構造の相違を強調させて,その目的を達したことがあった[6]
(Fig.. 2).また,後述するが二酸化炭素と3とが閉環した形の化合物 ephedroxane(11)が麻黄に含まれる.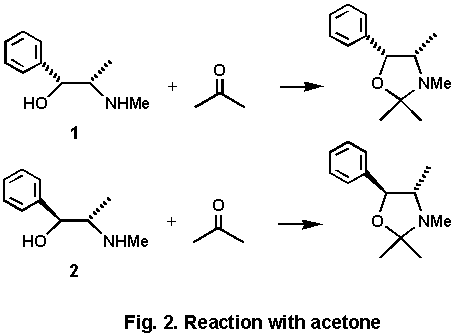
麻黄塩基の分離定量
先に述べたガスクロマトグラフィー法をはじめ,各種の分離定量法が考案されたが,自然淘汰され,現在,最も確実で簡便,迅速な方法として,相楽らの開発したペアードイオンによる液体クロマト法が推賞出来る[7].
我々は以前,13C-NMRによる分離定量を行ったことがある.装置の簡便性や迅速性,定量値の再現性等に関しては前法に劣るが,後に述べる生合成実験に巧みに利用されたいきさつもあるため,簡単に紹介する[8].
麻黄塩基のC13-NMRによる分離定量
生薬の麻黄20gを熱水で抽出し,簡単な振り分け操作で塩基性分画を中和して,重水1mlに溶かして内部標準物質としてモルフォリン塩酸塩を加え13C-NMRを測定する.定量の為にT1を考慮して,パルス間隔を20秒に取ったが,約30分の測定で十分なスペクトルが得られた.1と2は芳香環のシグナルに一部の重なりが見られるが,その他のシグナルはきれいに分離し,標準物質のピークとの高度比をとることにより,炭素の数だけ,複数の補正曲線が得られるため,1回の測定でバラツキの少ない定量結果が得られた.この方法の最も優れたところは,物質の同定に関する情報である.
ephedrine (1)の生合成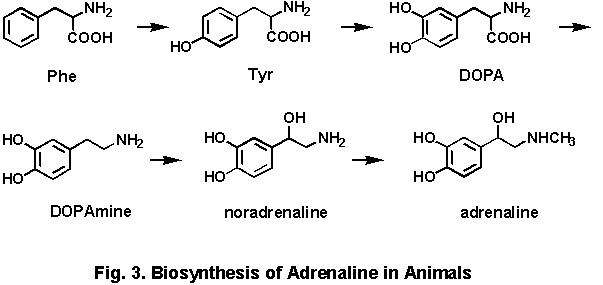
(1)初期の研究
ephedrineがマオウの植物中,どのような経路で生合成されるかについては1950年代から柴田承二教授のグループで研究が開始された.当初は,類似構造を持つadrenalineが,副腎においてphenylalanine,
の芳香環が段階的に酸化されてtyrosine, DOPAを生じ,それが脱炭酸してDOPAmineとなり,ベンジル位が酸化されてnoradrenaline,
最後にN-メチル化により生合成される経路(Fig. 3)が分かっていたので,同様な経路が考えられたが,初期の実験ではphenylalanineと,C-1単位のmethionineしか効果的な前駆物質が見いだせなかった.
(2)前駆物質C6-C1の発見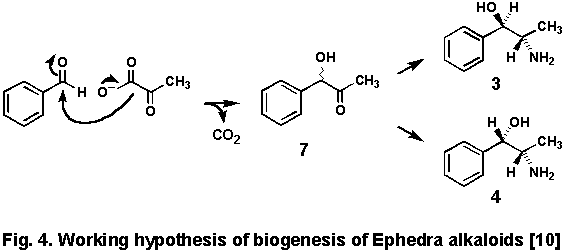
1960年代の後半に著者もこの研究に参加し,数々の試行錯誤を重ねた結果,
phenylalanineはephedrine(1)の前駆物質には違いないが,導入される炭素は7個だけで,側鎖の残りの2個の炭素は全く1の生合成には関与していないことが分かった.更に,C6-C1化合物として安息香酸が高い割合で
1 に導入されることを見いだした[9].ベンズアルデヒドにアラニンが脱炭酸とともに反応すると3が生ずるという反応が知られているため,Fig.
4のような生合成経路を考え,残るC2-N単位の候補を探ったが,効果的な前駆物質を見いだす事が出来なかった.
(3)ピルビン酸の貢献
それから15年経って,カナダのスペンサー等は残りの単位の前駆物質としてのピルビン酸を証明した.彼らは[2,3-13C2]pyruvateをマオウに投与して,そのマオウから得た塩基性分画を前述の方法に従って13C-NMR分析を行った.
その結果,ピルビン酸の導入された位置に予想される13C-13Cのカップリングが観測され,長年の謎が解かれた[10].ところが,この経路から当然予想される中間体の
1-hydroxy-1-phenylpropan-2-one(7)は予想に反して1に導入されなかった.そこで,1の直前の前駆物質として,さらに新しいものが考えられた.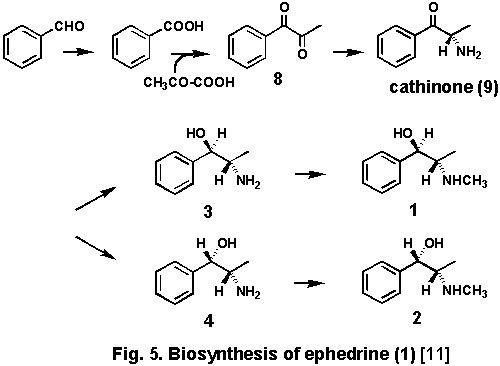
(4)ジケトンの導入とカチノンの勝利
ベンズアルデヒドから一段階酸化の進んだ安息香酸が何らかの酵素の作用で,脱炭酸したピルビン酸が結合すると,ジケトン(8)が生ずる.8がtransaminationを受けるとcathinone
(9)が出来るが,9は Ephedra属からは見つかっていないが,3と4を含むことが知られるアフリカ産のニシキギ科の潅木Catha
edulisからは報告されている.そこで側鎖の炭素を13Cで三重標識した8と9を投与したところ,1への標識原子の移行が認められ,特に9の場合には
satelite signalしか見えない程の驚くべき高率で導入された.かくして,この研究が開始してから30年以上かかってようやくephedrineの生合成の全貌が明らかになったといえる[11](Fig.
5).
また,生合成に関連して,最近,米田らは分離定量により,草質茎において,3→1→5の生成順を確かめるとともに,草質茎を一旦総て切除すると,その後生育する草質茎には麻黄塩基が生合成されないという興味ある結果を得ている[12].
その他のNを含む成分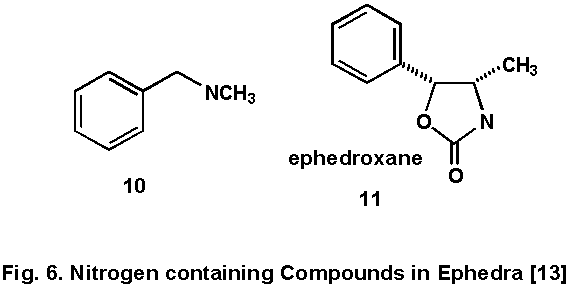
ephedrine型アルカロイド(麻黄塩基)とは別にベンジルメチルアミン(10)もマオウから得られている.これも,C6-C1単位を持つため,1と同様な生合成経路が推察される.
弱い抗炎症作用を有する化合物として,ヒキノらにより ephedroxane (11)が報告されているが,これは図2のアセトンの代わりにCO2が1と反応したもので,合成により確認された[13](Fig. 6).
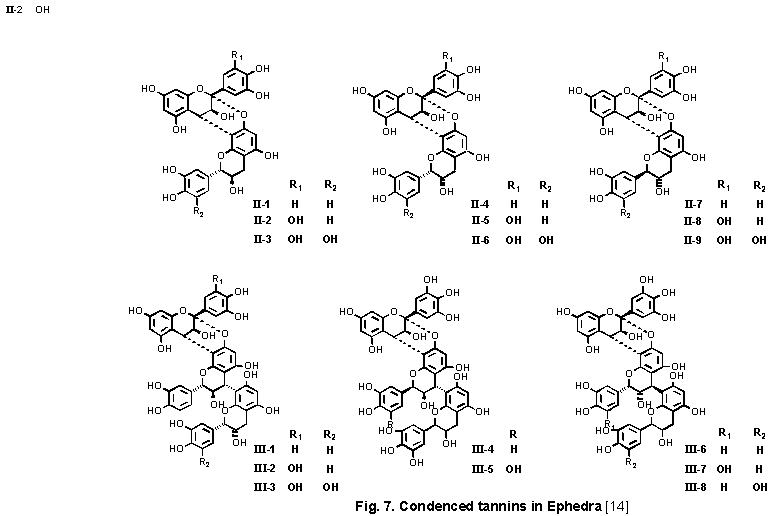
縮合型タンニン
西岡らのグループの研究により,麻黄から血清中の尿素窒素量低下活性を有するタンニンが報告された.いずれも flavan-3-ol(いわゆるカテキン)を構成単位とするが,構造決定されたもののうち,二量体と三量体の一部を図示する.四量体の存在も予知されている[14](Fig.
7).
多糖体について
ヒキノらによりマオウからephedran A-Eと命名された5種の多糖類が単離された.それらは5−7個の単糖類から構成され,いずれも,血糖降下作用を有する.それらの構造に関する情報は不十分だが,マオウの血糖降下活性を代表する成分であることに間違いはない[15].
麻黄根の成分 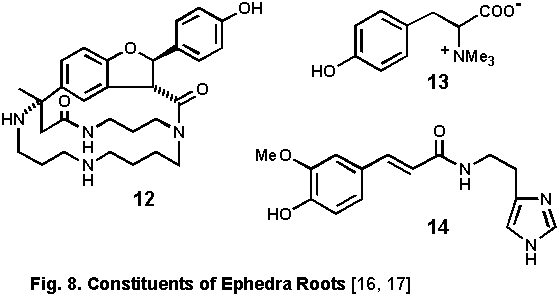
麻黄の根は赤褐色を呈し,昔から地上部とは逆に汗を止める目的に利用された.この生薬が市場に出回ることは稀だが,ヒキノらによる成分研究により,3種の含窒素化合物が報告されている.ephedradine
A (12)はスペルミジン型の大環状アルカロイドで,feruloyl histamine (14)とともに血圧降下作用が観測された[16].maokonine
(13)はチロシンのベタインに相当する化合物で,逆に血圧上昇作用が観測された[17](Fig. 8).
むすび
エフェドリンを中心とする麻黄塩基がやはり,麻黄の活性の主役であることは間違いがない.しかし,最近の研究により明きらかにされつつあるタンニンや多糖類も何らかの意味でマオウの薬能に貢献しているに違いない。例えば,麻黄の名前の基となった舌を痺れさせる作用はエフェドリンよりもむしろ、タンニンによるものであろう.今後の更なる研究が待たれる.
参考文献および注
[1] 第12改正日本薬局方.マオウは第2部医薬品各条,1 は塩酸エフェドリンとして第1部医薬品各条に収載されている.
[2] sinica種と共通であるとの説もある.中国ではこの学名を採用していない.
[3] 発見者により,epirenamine(局方名), epinephrine (英米で汎用)とも呼ばれる.
[4] (-)-はこの化合物の旋光度が負(左旋性)であることを意味する.以前は,イタリック体の小文字 l- の接頭語を使ったが,IUPACでは使用の中止を勧告している.なお,右旋性(+)は以前は d-
を使った.
[5] T. L. Giam and M. L. Go: Inhibition of Acetylcholineesterase
by Diastereomers of 2-Methylamino-1-phenylpropanol and Their Derivatives.
Chem. Pharm. Bull., 37, 2423-2426 (1989)
[6] K. Yamasaki, K. Fujita, M. Sakamoto, K.Okada, M. Yoshida and
O.Tanaka: Separationand Quantitative Analysis of Ephedra Alkaloids
by Gas Chromatography and Its Application to Evaluation of Some
Ephedra Species collected around Himalaya. Chem. Pharm. Bull.,
22, 2898-2902 (1974)
[7] K. Sagara, T. Oshima and T. Misaki:A Simultaneous Determination
of Nor1, Pseudo1, Ephedrine and Methyl1 in Ephedrae Herba and
Oriental Pharmaceutical Preparations by Ion-Pair High-Performance
Liquid Chromatography. Chem. Pharm. Bull., 31, 2359-2365 (1983)
[8] K. Yamasaki and K. Fujita: Qualitative and Quantitative Analysis
of Ephedra Alkaloids in Ephedrae Herba by Carbon-13 Nuclear Magnetic
Resonance. Chem. Pharm. Bull., 27, 43-47 (1979)
[9] K. Yamasaki, T. Tamaki, S. Uzawa, U. Sankawa, S. Shibata:
Participation of C6-C1 Unit in the Biosynthesis of Ephedrine in
Ephedra, Phytochemistry, 12, 2877-2882 (1973)
[10] G. G-Sorensen and I. Spenser: Biosynthesis of Ephedrine,
J. Am. Chem. Soc., 110, 3714-3715 (1988)
[11] G. G-Sorensen and I. Spenser: Bio-synthesis of Ephedra Alkaloids:
Evolution of thd C6-C3 Skeleton. J. Am. Chem. Soc., 115, 2052-2054
(1993)
[12] K.Kajimura, Y.Iwamoto, K.Yamasaki, Y.Sakagami, H.Yokoyama
and K.Yoneda: Variation of Growth and Contents of Ephed-rine Type
Alkaloids in Ephedra distachya, Natural Medicines, 48, 122-125
(1994)
[13] C. Konno, T. Takashi, M. Tamada and H. Hikino: Ephedroxane,
Anti-Inflammatory Principle of Ephedra Herbs. Phytochemistry,
18, 697-698 (1979)
[14] 西岡五夫:タンニンに関する最近の研究,薬学雑誌 103, 125-142 (1983)
[15] C. Konno, T. Mizuno and H. Hikino: Isolation and Hypoglycemic
Activity of Ep-hedrans A-E, Glycans of Ephedra distachya Herba.
Planta Medica, 162-163 (1985)
[16] M. Tamada, K. Endo, H. Hikino and C. Kabuto: Structure of
Ephedradine A, A Hypotensive Principle of Ephedra Roots.Tetrahedron
Letters, 873-876 (1979)
[17] M. Tamada, K. Endo and H. Hikino:Maokonine, Hypertensive
Principle of Ephedra Roots. Planta Medica, 34, 291-293 (1978)